Utilisation de l’azote liquide en cuisine. Démonstration L.P. Bougainville, Nantes, (05/03/2008). |
OBJECTIFS ET COMPÉTENCES VISÉS PAR CETTE DÉMONSTRATION
Comment obtenir de l’azote liquide.
Mise à jour des compétences professionnelles et éveil à la gastronomie moléculaire (possibilité de nouvelles applications culinaires : créativité)
CONTENU DE LA DÉMONSTRATION
Explication des règles de sécurité quant à l’entreposage et la manipulation de l’azote liquide
Description des phénomènes physiques observés par le biais de la gastronomie moléculaire.
- avec un fouet
- dans un bain (aliments glacés extérieurs et coulants à l’intérieur/désintégration)
- à la plancha (macarons glacés)
APPROCHE ET MÉTHODE PÉDAGOGIQUES
-
Dégustation pédagogique
-
Apports théoriques liés à l’utilisation de l’azote liquide
_______________________________________________________________________________________________________________________
|
Sous traitant de l’AIR LIQUIDE Azote ServicesLes Landes Vertes 44840 LES SORINIERES Tél. (02) 40 31 21 47 Fax (02) 40 31 21 42 Pour tout contact : contact@azote-services.fr
|
|
Récipient de stockage de l’azote TR (non préssurisé, isolé)
Les TR sont des récipients non pressurisés destinés au stockage et au transport d’azote liquide.
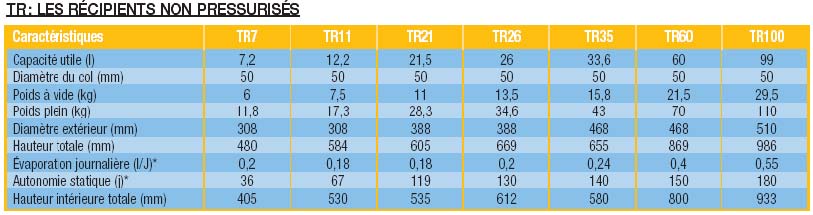 |
|
Récipient de travail AGIL (non pressurisé, isolé sous vide)
Les AGIL sont des récipients en acier inoxydable isolés sous vide. La gamme se décline en 6 modèles dont la capacité s’échelonne de 0,5l à 6l. Ils peuvent être équipés de bouchons (en option).
Si les AGIL sont souvent destinés à la manipulation d’azote liquide, leur domaine d’utilisation couvre une large plage de températures de -200°C à +200°C, ce qui les rend adaptables à un grand nombre d’applications.
|
|
Equipement de sécurité
- une paire de gants cryogéniques Fourniture Azote liquide
L’azote se commande à la charge
|
| 3 - Explication des règles de sécurité quant à l’entreposage et la manipulation de l’azote liquide |
|
LES CONSIGNES DE SECURITE
Les consignes suivantes doivent être impérativement respectées en présence d’azote liquide. En effet l’utilisation de ce gaz comporte des risques et il convient de prendre quelques précautions notamment face :
Une fois informé des risques et des conditions environnementales, tout utilisateur doit être à même d’employer l’azote liquide réfrigéré en toute sécurité.
3.1 LA SOUS-OXYGENATION
3.1.1 Rappel
La composition volumétrique approximative de l'air, quant à ses composants principaux, est :
Les gaz atmosphériques ne sont pas toxiques mais des changements de leur concentration relative, spécialement celle de l’oxygène, ont un effet sur les processus de la vie et de la combustion. Il est donc indispensable que le gaz que l’on respire contienne suffisamment d’oxygène (>19%) Nos sens ne peuvent pas détecter en temps utile les changements de concentration des constituants de l’air car ils sont inodores et incolores.
3.1.2 Dangers
Le risque d’asphyxie est dû à l'évaporation normale de l'azote liquide réfrigéré qui devenu gazeux prend la place de l'oxygène dans l'air. A titre d’exemple, dans les conditions standards de température et de pression (20°C; 1013mbar), 1 litre d'azote liquide s'évapore pour donner 680 litres d'azote gazeux. Le seuil d'alerte en O2 est facilement atteint. La sous-oxygénation est dangereuse et peut provoquer la mort par asphyxie. La réaction de l'organisme à la sous-oxygénation est très variable d'une personne à l'autre. Il n'est pas possible de donner des indications très précises et universellement valables sur les symptômes d’asphyxie.
3.1.3 Causes
Pour se prémunir contre le risque de sous-oxygénation de l'atmosphère, il convient de prendre garde aux points suivants lors des opérations et des phénomènes de :
Cette liste est non exhaustive.
3.1.4 Recommandations
Pour évite les risques de sous oxygénation, il faut :
3.1.5 Conduite générale à tenir en cas d’accident
Il faut :
Dans le cas d’un dispositif transportable, reportez-vous à la notice d’utilisation & de maintenance. Si le renversement survient dans un véhicule :
Cette liste est non exhaustive.
3.2 LES BRULURES CRYOGENIQUES
3.2.1 Rappel
L’azote liquide est extrêmement froid (-196°C) Les parties des dispositifs qui ont été en contact avec l’azote liquide (notamment lors du remplissage de celui-ci) peuvent provoquer une brûlure en cas de contact avec la peau.
3.2.2 Dangers
Les fluides cryogéniques peuvent :
3.2.3 Causes
Il existe deux sortes de brûlures cryogéniques :
Lors de la manipulation des échantillons et plus généralement lors de toute mise en œuvre d’azote liquide réfrigéré, il est important de se protéger du risque de projections. Celles-ci provoquent des brûlures cryogéniques qui peuvent avoir de graves conséquences, particulièrement lorsqu’elles concernent les yeux ou le visage.
Le contact de la peau avec des matériaux froids provoque des gelures ou brûlures cryogéniques. L’aménagement intérieur des dispositifs ou les échantillons ne doivent jamais être touchés ou saisis à main nue.
3.2.4 Recommandations
Pour éviter les risques de brûlures, il faut :
Cette liste est non exhaustive.
3.2.5 Conduite générale à tenir en cas de projection d’azote liquide réfrigéré
- Laver l’œil à l’eau abondamment pendant au moins 15 minutes ; - Se conformer aux règles d’intervention de première urgence de votre établissement ; - Consulter un médecin.
- Ne pas frotter ; - Enlever si possible ou desserrer les vêtements ; - Dégeler les parties atteintes par un réchauffement modéré et progressif ; - Ne rien appliquer sur la zone brûlée ; - Se conformer aux règles d’intervention de première urgence de votre établissement ; - Consulter un médecin. Cette liste est non exhaustive.
3.3 LE RISQUE D’EXPLOSION 3.3.1 Dangers
Dans le cas d'entrave à l'évaporation de l’azote liquide réfrigéré, il peut y avoir surpression et rupture de l'équipement.
3.3.2 Causes
L’augmentation de pression dans le réservoir peut être due : Au mauvais entretien du réservoir ; A la prise en glace du col et de son bouchon. Cette liste est non exhaustive.
3.3.3 Recommandations
Pour éviter le risque d’explosion, il faut :
Ne jamais obturer le clapet de pompage du réservoir. Ce clapet joue le rôle d’un dispositif de sécurité pour éviter qu’une pression dangereuse ne puisse apparaître dans les couches d’isolation du réservoir cryogénique. Il est de plus recommandé de ne jamais retirer le bouchon de protection du clapet de pompage.
3.3.4 Conduite générale à tenir en cas d’accident
Même conduite que pour la sous-oxygénation. 3.4 ENRICHISSEMENT EN OXYGENE. 3.4.1 Dangers
L’enrichissement en oxygène peut provoquer le risque d’explosion et/ou d’incendie.
3.4.2 Causes
L’enrichissement en oxygène par suite de la liquéfaction de l’air ambiant peut se produire sur les parois froides d’un équipement non isolé contenant des fluides tels que l’azote liquide réfrigéré dont le point d’ébullition est inférieur à celui de l’oxygène.
3.4.3 Recommandations
Pour éviter le risque d’enrichissement dû à l’oxygène, il faut :
|
|
4.1 - Description des phénomènes physiques observés par le biais de la gastronomie moléculaire.
Des glaces et sorbets : Instantanés et veloutés (Les glaces et sorbets obtenus instantanément avec l'azote liquide sont moelleux et veloutés. )
Le froid, classiquement, sert à confectionner des glaces ou sorbets. Ces 2 préparations sont largement composées d'eau, laquelle est faite de petites 'choses' qui bougent dans tous les sens, comme des boules de billard : ce sont des molécules d'eau. Plus la température est élevée, plus ces molécules bougent rapidement ; inversement, quand on refroidit une matière, les molécules vont moins vite, de sorte que finalement, elles finissent par 'coller' les unes aux autres, quand la force des chocs ne parvient plus à les séparer. Le sucre des glaces et des sorbets, lui, est fait de molécules qui se lient aux molécules d'eau, de sorte que, quand le sirop refroidit, les molécules d'eau ont plus de mal à s'associer entre elles : il faut donc refroidir davantage le mélange pour que la cristallisation commence. Or, elle conduit à la formation de cristaux de glace pure, par empilement de molécules d'eau les unes avec les autres : les cristaux de glace qui se forment quand on refroidit un sirop sont des cristaux de glace pure, et il reste, entre les cristaux de glace, du sirop concentré. C'est d'ailleurs par utilisation du même phénomène que les Canadiens font des eaux-de-vie : ils mettent du cidre sur le rebord de la fenêtre, en hiver, pour que l'eau qui cristallise laisse un liquide enrichi en alcool. On obtient l'eau-de-vie en retirant le glaçon. C'est interdit par la loi, mais efficace. Pour revenir à notre sorbet, nous comprenons maintenant qu'il est fait d'un liquide visqueux (du sirop concentré, avec les molécules odorantes du fruit), où sont répartis des cristaux de glace d'eau. Ce qu'il est utile de savoir aussi, c'est que la taille des cristaux de glace dépend de la vitesse de refroidissement et de l'agitation. Quand on veut faire de gros cristaux, il faut refroidir lentement et sans bouger la préparation : c'est le granité. En revanche, lorsqu'on veut obtenir des cristaux plus petits, pour une texture plus lisse, il faut refroidir très vite en agitant vigoureusement. Pour obtenir une texture veloutée à partir d'appareils à glace ou à sorbet, rien ne vaut le grand froid procuré par l'azote liquide : versé dans un appareil à sorbet ou à glace, ce dernier fait des cristaux minuscules, ce qui donne une impression de velours en bouche. Mieux encore : ces sorbets et glaces ont plus de goût que ceux réalisés à la sorbetière, comme nous l'avons plusieurs fois démontré par des tests comparatifs. L'un de ces tests a été effectué devant une partie de l'équipe du GaultMillau, au restaurant La Table d'Anvers à Paris, en compagnie du pâtissier Philippe Conticini : tous les participants ont vu la différence considérable pour un sorbet citron et une glace à la vanille. Le goût de citron était plus puissant pour le sorbet réalisé avec l'azote liquide (l'effet a été comparé de nombreuses fois : il tient notamment à ce que les molécules odorantes et sapides se trouvent mieux exposées en raison de la plus grande surface totale de cristaux de glace), et la quantité de matières grasses a pu être réduite pour la glace à la vanille.
Des flocons et flocons givrés : Pour jouer sur les contrastes
L'usage de l'azote liquide n'est pas limité à la production de glaces ou de sorbets. La technique peut servir à obtenir des glaçons à partir d'eau-de-vie ou de liqueur. Chose difficile à faire à partir d'un simple congélateur. Pourtant, dans l'azote liquide, aucune eau-de-vie, aucune liqueur ne résiste. Il suffit d'en verser une rasade dans un récipient rempli d'azote liquide, et l'on récupère à l'écumoire des flocons d'eau-de-vie. Les possibilités sont innombrables, évidemment : à votre imagination de jouer. Les flocons givrés sont une autre application merveilleuse. L'azote liquide est intéressant ici, parce que, dans le monde merveilleux de ce qui se mange, les 'contrastes' sont importants. Les pâtissiers jouent d'ailleurs de façon intuitive sur les contrastes des couleurs, des textures, des goûts, des sons… lorsqu'ils empilent les couches, dans les gâteaux, avec des goûts différents, des consistances différentes… Comment jouer sur les contrastes dans les métiers de la glace ? Par exemple avec des flocons givrés. Battons un blanc en neige, puis ajoutons du sucre et battons encore ; nous obtenons un appareil à meringue, que nous pouvons laisser tomber dans l'azote liquide : la partie périphérique congèle (puisque le blanc d'Ïuf, c'est 90 % d'eau), tandis que le coeur reste parfaitement tendre. Et comme le changement de température est brusque, la différence est importante. En revanche, si l'on avait refroidi lentement, il n'y aurait pas eu de différence, et tout aurait été homogène. Bref, c'est parce que l'azote liquide est très froid, bien plus froid que les congélateurs, que l'on parvient à ce résultat délicieux.
Des cristaux de vent glacés : Légers et craquants
Une variante de cet objet s'obtient quand on prépare des cristaux de vent, qui découlent de la question : quel est le volume maximal de blanc en neige que l'on peut obtenir à partir d'un seul blanc d'oeuf ? Classiquement, la réponse est environ 1/5e de litre (maximum). Du coup, la nouvelle question qui se pose est : pourquoi n'obtient-on pas davantage de mousse ? Pour y répondre, il faut savoir que le blanc d'oeuf est composé de 90 % d'eau et de 10 % de protéines, molécules analogues à de minuscules colliers de perle repliés sur eux-mêmes, et qui, lors du battage des blancs d'oeufs en neige, viennent tapisser la surface des bulles d'air. Du coup, puisque le blanc d'oeuf est ainsi composé, on doit déduire que, si l'on n'obtient pas davantage de volume quand on bat un blanc d'oeuf en neige, c'est qu'il manque quelque chose. Quel ingrédient fait défaut ? Ce n'est pas l'air dont on fait des bulles, puisque nous sommes entourés d'air, et que l'on double le volume de mousse quand on utilise deux blancs d'oeufs au lieu d'un seul. C'est donc soit l'eau, soit les protéines qui manquent. Pour trancher entre ces deux possibilités, rien ne vaut l'expérience et, de préférence, l'expérience simple : il est simple de battre un blanc d'oeuf, de lui ajouter de l'eau, de battre encore, d'ajouter de l'eau… et ainsi de suite jusqu'à ce que l'on soit limité par la quantité de protéines. Évidemment, une expérience n'est pas un plat, et il faut maintenant produire quelque chose de mangeable : pourquoi ne pas remplacer l'eau ajoutée par un liquide aqueux qui ait bon goût, tels une infusion de menthe, du jus d'orange ou de citron ? Avec du sucre ajouté, la tenue de la mousse est augmentée. Et si on laisse tomber cette mousse qui a du goût dans l'azote liquide, on obtient à nouveau un cristal de vent glacé merveilleux.
L'huile d'olive chantilly : De la mayonnaise cristallisée
L'huile d'olive chantilly est un autre exemple de ce que l'on peut réaliser quand on manie le grand froid. Chacun connaît la chantilly, que l'on obtient en battant de la crème, puis en sucrant le résultat. Sur le même principe, j'avais introduit successivement le chocolat chantilly (1995 : une mousse de chocolat, sans crème ni Ïufs : c'est le chocolat qui mousse), ou le foie gras chantilly, le beurre chantilly, le beurre noisette chantilly ou encore le fromage chantilly. Longtemps, l'huile m'a résisté, mais l'azote liquide permet de la produire (en réalité, un bon congélateur suffit). Considérons le lait - mais seulement pour l'explication : c'est une émulsion, avec des matières grasses sous la forme de gouttelettes microscopiques dispersées dans l'eau du lait (il y a bien d'autres molécules, mais il n'est pas nécessaire de les évoquer ici). Quand on laisse cette émulsion reposer, la matière grasse remonte vers la surface, formant la crème, qui est donc une émulsion plus concentrée en matière grasse que le lait, mais de même nature physique. Fouettons : le fouet introduit des bulles d'air, tandis qu'il provoque la fusion limitée des gouttelettes de matières grasses, lesquelles viennent tapisser la surface des bulles ; on obtient la crème fouettée. Sucrons : on obtient la chantilly. br> L'idée est de reproduire l'effet. Nous devons partir d'une émulsion : il nous suffit de réaliser une mayonnaise, à partir de jaunes d'Ïufs, dans lequel on bat de l'huile (je rappelle que la mayonnaise ne doit pas contenir de moutarde, sans quoi elle devient une rémoulade, au goût très différent). Puis il nous suffit de fouetter la mayonnaise en la refroidissant à une température où la graisse cristallise : c'est là que l'azote liquide est précieux… puisqu'il nous permet de faire une huile chantilly.
Les poudres d'aliments : Cassantes et parfumées
Tous les aliments, qu'ils soient riches en matières grasses ou non, se transforment en poudre cassante et parfumée lorsqu'ils sont soumis au très grand froid de l'azote liquide. Les poudres de matières grasses sont de réalisation très simple, avec de l'azote liquide. Pour comprendre, il suffit de savoir que l'huile cristallise quand on la met au réfrigérateur. Du coup, faisons tomber un filet d'huile d'olive dans de l'azote liquide, et on obtient une poudre cassante d'huile d'olive. De même pour toutes les matières grasses : le chocolat fondu, le beurre fondu (noisette ou nature), le fromage fondu… Les poudres de légumes, de fruits, de viandes, de poissons, de fromages ne sont pas plus difficiles à obtenir. Il suffit de savoir que la majorité des aliments sont composés d'eau. Par exemple, la laitue est composée de 99 % d'eau, la viande de 80 %. Faisons tomber une feuille de laitue dans l'azote liquide : son eau congèle, de sorte que la feuille devient craquante. Brisons-la entre les mains : on obtient une poudre de laitue. On comprend que l'on puisse faire de même pour tous les autres produits alimentaires : basilic, menthe, viande, poisson, fromage…
(Source : Hervé This) (Journal de l’Hôtellerie 02/11/2007) |
© Copyright 2002 - MesMotsCourts culin@ires - Tous droits réservés





